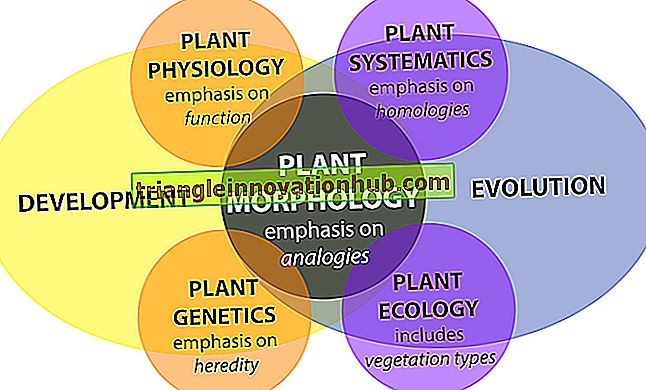
Enzim: Adlandırılması, Kimyasal Yapısı ve Mekanizması
Enzim: Adlandırma, Kimyasal Yapı ve Mekanizma!
Proteinlerin canlı hücrelerde en önemli fonksiyonlarından biri enzim olarak hareket etmektir.
“Enzim” kelimesi ilk olarak 1878'de Kuhne tarafından tanıtılmıştır. Orijinal Yunanca kelime enziminden (Gr. En-in, zyme-leaven) türetilmiştir.
1896'da Buchner, maya hücrelerinden fermantasyonda aktif olan bir maddeyi çıkarmayı başardı. Bu maddeye daha sonra zymase adı verildi ve fermantasyonda yer alan enzim sisteminin bir parçası. 1926'da, Profesör JB Sumner, Jackton'dan izole edilmiş, aseton vasıtasıyla, enzim üreaz kristal şeklindedir.
Tanım:
Bir enzim, vücudundaki çeşitli fizyolojik süreçleri düzenlemek için hücrelerinde yaşayan bir organizma tarafından üretilen karmaşık bir biyolojik katalizör olarak tanımlanabilir. Canlı hücrelerin dışında işlevsel olan enzimlere, örneğin sindirim sularında bulunan enzimler, gözyaşı lizozimi, ekzoenzimler denir. Canlı hücrelerin içinde işlevsel olan enzimler, örneğin Krebs döngüsünün enzimleri, glikoliz enzimleri vb. Endozimler olarak bilinir.
Bir enzimin etki ettiği maddeye "substrat" denir ve genel olarak konuşmak gerekirse, enzimin kendisi, substratın "ase" ekini ekleyerek substrattan sonra adlandırılır. Dolayısıyla, örneğin proteazlar, proteinlere etki eden bir enzim grubudur, lipazlar, lipit maddelere etki eden bir enzim grubudur ve maltaz, maltoza etki eden enzimin adıdır.
Bazen bir enzimin adı, meydana getirdiği reaksiyonun doğasını gösterir. Örneğin, sakarozu glikoz ve fruktoz içine kıran invertaz, ters çevrmeye neden olur (bu, bir tür optik dönme gösteren hammaddenin, ters yöndeki optik dönme tipini gösteren son ürünleri vermesidir).
İsimlendirme:
Enzim terminolojisinin incelenmesi, birçok durumda hem yanıltıcı hem de yanıltıcı olduğunu ortaya koymaktadır. Ayrıca, farklı biyokimyacıların aynı enzim için farklı isimler verdiği yerlerde de örnekler yoktur. Bu anormallik, 1961'deki raporunda Uluslararası Enzimler Komisyonu tarafından kaldırılmıştır.
Komisyon, her bir enzimin aşağıdakilerden oluşması gerektiğini kabul etmiştir: (1) substratın adı ve (2) süksinik dehidrojenaz, piruvat transaminazda olduğu gibi bir çeşit katalitik reaksiyonu tanımlayan 'ase' ile biten bir kelime. Bu isimlendirme kesin ve sistematiktir, ancak bazı durumlarda uzun ve dil bükümlüdür. Bu nedenle, önemsiz isimler resmi yaptırımla ancak sadece sistematik isimlerine atıfta bulunarak saklanır.
Modern enzim sınıflandırma sistemi 1961'de Uluslararası Biyokimya Birliği (IUB) tarafından tanıtıldı. Enzimleri aşağıdaki altı kategoride gruplandırıyor.
1. Oksidoredüktazlar:
Yükseltgenme ve indirgenme reaksiyonlarında veya elektron transferinde rol alırlar. Oksidoredüktazlar üç tiptir: oksidazlar, dehidrojenazlar ve indirgemeler, örneğin, sitokrom oksidaz (sitokrom okside eder), süksinat dehidrojenaz, nitrat redüktaz.

2. Transferazlar:
Bir grubu bir molekülden diğerine, örneğin, glutamat-piruvat transaminaza aktarırlar (amino grubunu, alaninin sentezi sırasında glutamattan piruvata aktarırlar). Kimyasal grup transferi Özgür Devlet'te gerçekleşmez.

3. Hidrolazlar:
Hidrojen ve hidroksil su molekülleri gruplarının yardımıyla büyük molekülleri küçük moleküllere ayırırlar. Bu fenomene hidroliz denir. Sindirim enzimleri bu gruba aittir, örneğin, amilaz (nişastanın hidrolizi), sükraz ve laktaz.

4. Lyases:
Enzimler yarılma, hidrolizsiz grupların çıkarılması, çift bağlara veya tersine grupların eklenmesi, örneğin, histidin dekarboksilaz (histidinin histamine ve C02'ye ayrılması), aldolaz (fruktoz-l, 6-difosfatı dihidroksi aseton fosfat ve gliseralde fosfat için) meydana getirir ).

5. İzomerazlar:
Enzimler, molekül yapısının yeniden düzenlenmesinin izomerik değişiklikleri etkilemesine neden olur. Bunlar üç tip, izomeraz (glikoz 6-fosfat ila fruktoz 6-fosfat gibi ketoz grubu ketoz grubu), epimerazlar (bir bileşenin pozisyonunda değişiklik veya ksilüloz fosfat gibi karbon grubunun pozisyonunda değişme) ve mutaslar (mutasyonlar) Glikoz-fosfat gibi yan grubun pozisyonu, glukoz-l-fosfata).

6. Ligazlar:
(Sentetazlar). Enzimler, ATP'den elde edilen enerji, örneğin, fosfenol piruvat PEP karboksilaz ile iki kimyasalın bağlanmasını katalize eder (fosfenol piruvat ile ATP'nin hidrolizi eşliğinde karbon dioksit oluşturan oksaloasetat ile birleştirilir).

Uluslararası Biyokimya Birliği (IUB) tarafından tanıtılan modern enzim isimlendirme sistemi, herhangi bir enzime dört sayı vermenin bir yöntemini öngörmektedir; ilk sayı, enzimin düştüğü ana sınıfı belirten birinci sayı, ikincisi üçüncü ve alt sınıfları gösterir. ve dördüncüsü, özel alt sınıfındaki enzimin seri numarasıdır; dört sayı noktalarla ayrılmıştır.
Böylece malik dehidrojenaz, enzim komisyon numarası (Ec. No. 1) verilmiştir. 1.1.1.37. İlk 1, enzimin bir Oxidoreductase olduğunu gösterir, ikinci 1, enzimin CH-OH donör grubuna etki ettiğini gösterir ve üçüncü 1, enzimin desteklediği reaksiyonda, NAD veya NADP'nin bir alıcı molekül olarak işlev gördüğünü belirtir; bu özel enzime verilen seri numarasının son sayısı, 1.1.1'in gösterdiği özelliklerle karakterize edilen gruptur.
Enzimlerin Kimyasal Yapısı:
Tüm enzimler, yakın zamanda keşfedilen RNA enzimleri hariç, doğada proteinlidir (Sumner, 1926). Bazı enzimler ayrıca protein olmayan bir grup içerebilir.
Kimyasal yapıdaki farklılıklara dayanarak, enzimler aşağıdaki gibi tarif edilebilir:
(i) Basit Enzimler:
Bazı enzimler basit proteinlerdir, yani hidrolizde sadece amino asitleri verirler. Pepsin, tripsin ve kimotripsin gibi sindirim enzimleri bu niteliktedir.
(ii) Konjugat Enzimleri:
İki parçadan oluşan bir enzimdir - apoenzim (örneğin flavoprotein) denilen bir protein kısmı ve kofaktör olarak adlandırılan protein olmayan bir parça. Bir apoenzim ve bir kofaktörden oluşan tam konjugat enzime holoenzim denir.
Sadece her iki bileşen (apoenzim ve kofaktör) bir arada bulunduğunda enzimatik bir aktivite olabilir. Kofaktör bazen basit bir çift değerli metalik iyondur (örn., Ca, Mg, Zn, Co, vb.) Ve bazen de protein olmayan bir organik bileşiktir. Bununla birlikte, bazı enzimler her iki kofaktör türünü de gerektirir. Kofaktör apoenzime sıkıca bağlıysa prostetik grup olarak adlandırılır.
Örneğin, sitokromlar, protez grupları olarak porfirin içeren enzimlerdir. Eğer apoenzime az çok kalıcı olarak bağlı kalmak yerine, kofaktör kendisini yalnızca reaksiyon zamanında apoenzime bağlarsa, buna koenzim adı verilir.
(iii) Metallo-enzimler:
Enzimik reaksiyonlarda yer alan metal kofaktörler hem monovalent (K + ) hem de iki değerli katyonlardır (Mg ++, Mn ++, Cu ++ ). Bunlar, enzim tarafından gevşek olarak tutulabilir veya bazı durumlarda molekülün kendisinin bileşimine girer. Metal, hemoglobin demiri veya sitokrom demiri olarak molekülün bir parçasını oluşturursa, enzimlere metalo-enzimler adı verilir.
(iv) İzoenzimler (İzozimler):
Bir zamanda, bir organizmanın belirli bir metabolik reaksiyon basamağı için tek bir enzime sahip olduğuna inanılıyordu. Daha sonra, bir substratın, aynı ürünü üreten bir enzimin çeşitli varyantları tarafından etki edilebileceği keşfedildi.
Aynı organizmada meydana gelen ve benzer bir substrat aktivitesine sahip olan bir enzimin çoklu moleküler formlarına izoenzimler veya izozimler denir. 100'den fazla enzimin izoenzimlere sahip olduğu bilinmektedir. Dolayısıyla, buğday endosperminin a-amilazı 16 izozime sahiptir, laktik dehidrojenaz insanda 5 izoenzime sahiptir, alkol dehidrojenaz ise mısırda 4 izozime sahiptir. İzoenzimler aktivite optimasyonu ve inhibisyonunda farklılık gösterir.
En ayrıntılı incelenen izozim, nişasta jel elektroforetik ayrımı ile gözlemlendiği gibi, en fazla omurgalı organında beş olası biçimde oluşan laktik dehidrojenazdır (LDH). Temel olarak iki farklı LDH tipi ortaya çıkar. Nispeten düşük konsantrasyonlarda piruvat tarafından kuvvetli bir şekilde inhibe edilen bir tip, kalpte baskındır ve kalp LDH'si olarak adlandırılır.
Piruvat tarafından daha az kolayca inhibe edilen diğer tip, birçok iskelet kasında meydana gelir ve bu nedenle kas LDH'si olarak adlandırılır. Kalp LDH'si, H alt birimleri olarak adlandırılan 4 aynı alt birimden oluşur. Kas LDH, 4 adet aynı M alt biriminden oluşur. İki tür alt birim H ve M farklı amino asit bileşimlerine, enzim kinetiğine ve immünolojik özelliklere sahiptir. Farklı kombinasyonlardaki bu alt birimler 5 izoenzim üretir.
Bu nedenle, çeşitli çevresel koşullara uyum sağlamada organizma için yararlıdırlar.
Enzim Eylem Mekanizması:
Enzim, verilen bir reaksiyonu teşvik eder, ancak reaksiyonun sonunda değişmeden kalır. 1913 yılında Michaelis ve Menten, enzimik aktivite sırasında bir ara enzim substrat kompleksinin oluşturulmasını önerdi. Konsepti göstermek için aşağıdaki şema yazılabilir:

Enzimler, kinetik özellikleri değiştirerek reaksiyon hızını hızlandıran biyolojik katalizörlerdir. Bu nedenle, enzim (E), bir enzim-substrat kompleksi (ES) oluşturarak geri tepebilir bir reaksiyonla enzim-substrat kompleksi (ES) oluşturarak katalitik rolünü uygular; buradaki K1, ES oluşumu için oran sabitidir ve K2, hızdır. ES'nin E ve S'ye ayrışması için sabit.
ES oluşumundan sonra, substrat (S) ürünlere dönüştürülür, böylece daha fazla substrat ile daha fazla kombinasyon için enzim (E) kullanılabilir hale gelir. ES'nin reaksiyonun ürünlerine dönüşüm oranı K3 sabiti ile gösterilebilir.
Her enzim katalizli reaksiyon, bir enzim ve substratın birbiriyle birleşme eğiliminin bir ölçüsü olan Michalies-Menten sabiti olan bir karakteristik Km değerine sahiptir.

Bu şekilde Km değeri, enzimin kendi substratı için afinitesinin bir endeksidir. Bir enzimin substratı için afinitesi ne kadar büyük olursa, Km değeri o kadar düşük olur.
Enzimler, Aktivasyon Enerjisini Azaltır:
Aktivasyon enerjisi, bir reaksiyonda yer almak için bir molekülün gerektirdiği minimum miktarda enerjidir. Enzimlerin etkisi, aktivasyon enerji gereksinimlerini düşürmek, böylece aksi takdirde mümkün olacağından daha düşük sıcaklıklarda kayda değer reaksiyon hızlarını teşvik etmektir.
Katalitik Siteler:
Enzimler, substrat moleküllerine kıyasla çok daha büyüktür. Dolayısıyla bir enzim substratında, substrat enzimik yüzeyin sadece çok küçük bir alanı ile temas halindedir. Enzimin amino asit kalıntıları ve substrat ile fiziksel temas halinde olan ancak bir araya getirilen katalitik aktivite için gerekli olan peptid bağlarını içeren bu kısmı, halihazırda katalitik bölge olarak adlandırılan bir aktif bölge oluşturur.
Katalitik bölge hariç, enzim molekülünün geri kalanı, katalitik bölgenin doğru üç boyutlu biçimini korumak için gerekli olabilir veya herhangi bir fonksiyonel rolü olmadan orada olabilir.
Bir katalitik sitenin yapısı bazı enzimlerde incelenmiştir. Papain ve ribonükleazdaki gibi enzim üzerinde bir çatlak veya karbonik anhidrazda olduğu gibi derin bir çukurdur. Katalitik sitenin şekli ne olursa olsun, doğru substratın, bir substrat-katalitik alan kompleksi meydana getiren katalitik siteye bağlandığına inanılmaktadır.
Üretken bağlama terimi genellikle bu komplekse uygulanır. Üretken bağlamada, hem enzimler hem de substratlar aktivasyon enerjisinde bir azalma ile yapısal değişiklikler gösterir, böylece substrat bir ürüne dönüştürülür.

Enzim Eylem Teorileri:
1. Kilit ve Anahtar Hipotezi:
İlk önce yaklaşık 1884'te Emil Fischer tarafından varsayılan enzim-substrat kompleksi, ikisi arasında sert bir kilit ve kilit birleşim olduğunu varsaymıştır. Substratın (veya substratların) bir ürüne dönüşme işlemi sırasında birleştiği enzim kısmına aktif bölge denir.
Aktif bölge belirli bir substrat için katı ve spesifik olsaydı, reaksiyonun tersinirliği oluşmazdı, çünkü ürünün yapısı substratınkinden farklıydı ve iyi uymuyordu.
2. Uyarılmış-Fit Teorisi:
Sert bir şekilde düzenlenmiş bir Fischer aktif bölgesi ile karşılaştırıldığı gibi, Daniel E. Koshland (1973), aktif enzim bölgesinin, substratın (veya ürünün) daha iyi bir kombinasyona izin veren bir konformasyon değişikliğine uğraması için yakın bir yaklaşımla tetiklenebileceğini kanıtladı. ikisinin arasında.
Bu fikir şimdi yaygın olarak uyarılmış uygunluk teorisi olarak bilinir ve aşağıda gösterilmiştir. Görünüşe göre, substratın yapısı birçok indüklenmiş uyum vakası sırasında da değiştirilir, böylece daha işlevsel bir enzim-substrat kompleksi sağlanır.

Enzimlerin Özellikleri:
1. Enzimin katalitik niteliği daha önce detaylı olarak tartışılmıştı.
2. Tersinirlik:
Teorik olarak, tüm enzim kontrollü reaksiyonlar geri dönüşümlüdür. Bununla birlikte, tersine çevrilebilirlik, enerji gereksinimlerine, reaktan mevcudiyeti, son ürünlerin konsantrasyonu ve pH'a bağlıdır. Eğer tepkenlerin kimyasal potansiyeli, ürünlerinkine kıyasla çok yüksekse, tepkime, kütle etkisinin kimyasal kanunu nedeniyle, sadece ürün oluşumuna doğru ilerleyebilir. Çoğu dekarboksilasyon ve hidrolitik reaksiyonlar geri döndürülemez.
Aynı enzim, yalnızca termodinamik olarak mümkünse bir reaksiyonun ileri ve geri hareketini kolaylaştırır. Solunum ve fotosentez yollarında inandırıcı bir örnek görülür. Glikoliz ve pentoz fosfat yolunun enzimleri glukozu özümser. Bu enzimlerin bazıları fotosentezde ters yönde çalışır ve karbondioksit ve sudan glikoz oluşturur.
3. Isı hassasiyeti:
Tüm enzimler ısıya duyarlıdır veya ısıya dayanıklıdır. Çoğu enzim optimal olarak 25-35 ° C arasında çalışır. Donma sıcaklıklarında etkisiz hale gelirler ve 50 ° -55 ° C'de denatüre olurlar. Ancak, termal algler ve bakteriler bir istisnadır. Enzimleri 80 ° C'de bile işlevsel kalır. Tohum ve sporların enzimleri de 60 ° -70 ° C'de denatüre edilmez.
4. pH duyarlı:
Her enzim, belirli bir pH, örneğin, pepsin (2 pH), sükraz (4-5 pH), tripsin (8, 5 pH) olarak işlev görür. PH değişimi enzimleri etkisiz hale getirir.
5. Faaliyetlerin özgüllüğü:
Enzimler, üzerinde katalitik rol oynadıkları substratlara özgüllük göstermektedir. Enzimlerin bu eşsiz özelliğine şu karar verilir: (1) substrat molekülünün yapısal konfigürasyonu, (2) enzimin konformasyonu ve (3) enzim üzerindeki aktif veya katalitik bölgeler. Enzimlerin substrat spesifikliği iki çeşittir: grup spesifikliği ve stereo özgüllük.
Enzimler genellikle grubun özgüllüğünü gösterir, yani sadece bir kimyasal olarak ilişkili bileşik grubuna saldırırlar. Grup spesifikliği göreceli bir grup spesifikliği olabilir; bu durumda enzim bir dizi homolog substrat üzerinde çalışır.
Bu nedenle, heksokinaz, fosfat grubunu ATP'den en az 23 heksoza veya bunların glukoz, mannoz, fruktoz ve glukozamin gibi türevlerine aktarır. Gruba özgü enzimlerden bazıları mutlak bir grup özgüllüğü sergiler, yani enzim, homologları yerine sadece tek bir bileşik üzerinde etki eder. Mannoz, glukokinaz ve fruktokinaz, sırasıyla heksoz, mannoz, glukoz ve fruktoz fosforilasyonlarında rol oynar.
Enzimler ayrıca substrata karşı stereo özgüllük gösterir ve hem optik hem de geometrik izomerler ile sergilenir.
(i) Enzim optik özgüllük gösterirse, bileşiklerin dekstro (D) veya laevo (L) izomerine etki eder. Böylece, D. aminoasit oksidaz sadece D. okside eder D. amino asitler ve L. aminoasit oksidazlar sadece L. aminoasitler ile reaksiyona girer.
(ii) Geometrik özgüllük cis ve trans izomerlerine karşı sergilenir. Fumarik ve malik asitler iki geometrik izomerdir. Fumarik hidrataz, sadece trans-izomer fumarik aside etki eder, ancak cis-izomer malik aside etki etmez.
6. Enzim inhibisyonu:
Enzim katalizli bir reaksiyonun hızını azaltan maddeler veya bileşikler inhibitörler olarak bilinir ve fenomen enzim inhibisyonu olarak tanımlanır. Üç tür engelleme vardır.
(i) Rekabetçi engelleme:
Bir bileşik, enzim proteini üzerindeki aktif bölge için bir substrat ile rekabet ettiğinde ve böylece bu enzimin katalitik aktivitesini azalttığı zaman, bileşiğin rekabetçi bir inhibitör olduğu kabul edilir. Reaksiyon karışımına basitçe daha fazla substrat eklenerek tersine çevrilen bu tür yapısal analogların (antimetabolitler adı verilen) inhibisyonu, rekabetçi inhibisyon olarak bilinir.

Örneğin, süksinat dehidrojenaz kolayca süksinik asidi fumarik aside okside eder. Yapıdaki süksinik aside çok benzeyen artan malonik asit konsantrasyonları eklenirse, süksinik dehidrojenaz aktivitesi büyük ölçüde düşer.
İnhibisyon şimdi sırayla substrat süksinik asidin konsantrasyonunu artırarak tersine çevrilebilir. Bu inhibisyon tipindeki inhibisyon miktarı, (i) inhibitör konsantrasyonu, (ii) substrat konsantrasyonu ve inhibitör ve substratın nispi afiniteleri ile ilgilidir. İnhibitör etki geri dönüşümlüdür.
Bir inhibitörün rekabetçi olup olmadığı Lineiveaver-Burk Plot'u inşa ederek tespit edilebilir. Rekabetçi inhibitörler enzimin Km'sini değiştirir, çünkü aktif bölgeleri işgal ederler. Bununla birlikte, reaksiyonun maksimum V veya maksimum hızını değiştirmezler.
(ii) Rekabetçi olmayan engelleme:
Substrat konsantrasyonunun arttırılmasıyla tersine çevrilemeyen inhibisyona, rekabetçi olmayan inhibisyon denir. İnhibitör, aktif bölge dışındaki enzim üzerindeki bir bölge ile oldukça güçlü bir şekilde birleşir ve bu etki, sadece substrat konsantrasyonunu yükselterek üstesinden gelinmez.
Bu inhibisyon tipindeki inhibisyon miktarı, (a) inhibitör konsantrasyonu ve (b) enzim için inhibitör afinitesi ile ilgilidir. Substrat konsantrasyonunun bu sistem üzerinde bir etkisi yoktur ve rekabetçi olmayan inhibitörler, Vmax'ı değiştirir, enzimin Km'sini değiştirmez.
Siyanür, azid ve gümüş, cıva, kurşun vb. Gibi ağır metaller, esansiyel sülfhidril grupları veya enzimlerin metal bileşeniyle birleşen veya tahrip olan rekabetçi olmayan inhibitörlerin bazı örnekleridir.
(iii) Geri bildirim (son ürün) inhibisyonu:
Bir reaksiyonun son ürünü, çok reaksiyonu katalize eden enzimin etkisini inhibe ederek kendi öncüllerinden birinin oluşumunu önlemeye hizmet ettiğinde, inhibisyon geri besleme inhibisyonu olarak adlandırılır.

A'nın B'ye X ile dönüşümünün inhibisyonu, böyle bir inhibisyon olacaktır. Burada reaksiyonun nihai ürünü olan X, A'dan B'ye değişimi katalize eden a 'enziminin etkisini engelleyerek kendi öncüllerinden birinin (B) oluşumunu önlemeye hizmet eder.
Bu örnekte, 'a' enzimi, tüm sekans tarafından etkin bir şekilde düzenlendiğinden, kalp pili olarak adlandırılabilir. Gerçek bir örnek, E. coli'de aspartik asit ve karbamil fosfattan sitidin trifosfatın (CTP) oluşturulmasıdır.
Kritik bir CTP konsantrasyonu arttıkça, trifosfat, kendi sentezinin pacemaker basamağını katalize eden aspartat transkarbamilaz (ATCase) enzimini inhibe ederek kendi oluşumunu yavaşlatır. Trifosfatın konsantrasyonu metabolik kullanımla yeterince azaldığında, inhibisyon serbest bırakılır ve sentezi yenilenir.

Enzim Eylemini ve Enzim Kinetiğini Etkileyen Faktörler:
1. Enzim Konsantrasyonu:
Biyokimyasal reaksiyonun hızı, sınırlama veya doyma noktası olarak adlandırılan bir noktaya kadar enzim konsantrasyonundaki artışla artar. Bunun ötesinde, enzim konsantrasyonundaki artışın etkisi azdır.
2. Yüzey konsantrasyonu:
Substrat konsantrasyonunun enzim katalizli reaksiyonun reaksiyon hızı üzerindeki etkisinin ilk tatmin edici matematiksel analizi Michaelis ve Menten (1913) tarafından yapılmıştır. Sabit enzim konsantrasyonuyla, bir substrat artışı, ilk önce hız veya reaksiyon hızında çok hızlı bir artışa neden olacaktır.
Ancak, substrat konsantrasyonu artmaya devam ettikçe, reaksiyon hızındaki artış, büyük bir substrat konsantrasyonuyla birlikte, hızda başka bir değişiklik gözlenmeyene kadar yavaşlamaya başlar. Bu yüksek substrat konsantrasyonunda elde edilen reaksiyonun hızı, belirtilen koşullar altında enzim katalizli reaksiyonun maksimum hızı (Vm) olarak tanımlanır ve doygunluk seviyesinin altındaki substrat konsantrasyonları ile elde edilen başlangıç reaksiyon hızı V olarak adlandırılır.

Maksimum hızın yarısını (V m / 2) vermek için gereken substrat konsantrasyonu yukarıdaki şekilde kolayca belirlenebilir ve enzim kinetiğinde önemli bir sabittir. Michaelis sabitini veya Km'yi tanımlar. Başka bir deyişle, K, V = ½ Vm-Tamponun sıcaklık, pH ve iyonik kuvvet koşullarını dikkatlice tanımladığında, substrat konsantrasyonu olarak tanımlanır, bu sabit Km, bir enzim-substrat kompleksinin ayrışma sabitine yaklaşır. Km veya 1 / Km'nin karşılığı, bir enzimin substratı için afinitesine yaklaşır.

Enzim Eyleminin Kinetiği:
Michaelis sabiti K, bir reaksiyonu katalize eden bir enzimin etki modunu sağlamasından dolayı oldukça önemlidir. Düşük substrat konsantrasyonunda, hızın substrat ile ilişkisinin neredeyse doğrusal olduğu ve birinci dereceden kinetiklere uyduğu, yani, A - B reaksiyonunun oranının, substrat konsantrasyonu [A] ile doğru orantılı olduğu belirtilmelidir.
V = K '[A] düşük [substrat]
V, reaksiyonun [A] ve K 'konsantrasyonundaki gözlenen hızı olduğunda, spesifik hız sabitidir. Bununla birlikte, yüksek substrat konsantrasyonunda, reaksiyonun hızı maksimumdur ve substrattan [A] bağımsızdır; dolayısıyla sıfır dereceli kinetiğe uyar.
V m = K 'Doyma [Substrat]
Bu ilişkiyi tanımlayan ve ayrıca eğriyi tatmin edici bir şekilde açıklayan Michaelis-Menten denklemi şöyledir:
V = Vm [S] / Km + [S]
Burada V = verilen substrat konsantrasyonundaki ilk reaksiyon hızı [S]
Km = Michaelis sabiti, mol / litre.
V m = Doymuş substrat konsantrasyonlarında maksimum hız
[S] = Mol / litre cinsinden substrat konsantrasyonu
Michaelis-Menten denklemi ile bir enzim reaksiyonunun Km değerinin belirlenmesi pratikte zordur. Line-weaver-Burk arsası denilen bu denklemin bir sonucu genellikle bu belirleme için kullanılır.
1. Sıcaklık:
Bir enzim dar bir sıcaklık aralığında aktiftir. Bir enzimin en yüksek aktivitesini gösterdiği sıcaklığa optimum sıcaklık denir. Enzim aktivitesi bu sıcaklığın altına ve altına düşer. Katalizör olarak sıcaklıkla artan bir reaktivite gösterirler ancak proteinli yapıları onları optimum sıcaklığın üstünde termal denatürasyona duyarlı hale getirir.
2. pH:
Maksimum enzim aktivitesinin gerçekleştiği pH, bir enzimden diğerine önemli ölçüde değişir. Bu, pH optimum olarak bilinir. Her iki yöne küçük bir kayma, enzim aktivitesini önemli ölçüde azaltma eğilimindedir. Enzimler protein olduğundan, pH değişiklikleri normal olarak protein yüzeyi üzerindeki amino ve karboksilik asit gruplarının iyonik karakteristiklerini etkiler ve bu nedenle bir enzimin katalitik yapısını belirgin şekilde etkiler.

3. Hidrasyon:
Enzim, sürekli faz daha yüksek olduğundan, substratın arttırılmış kinetik aktivitesi altında maksimum fonksiyon gösterir. Bu nedenle, düşük su içeriğine sahip olan tohumların, substratlar içinde bolca yer almasına rağmen, asgari bir enzimik aktivite kaydettiklerini gösterir. Bununla birlikte, çimlenmede enzimik aktivite keskin bir şekilde artar ve bunun nedeni suyun emilmesi ve bunun sonucu olarak substrat moleküllerinin kinetik aktivitesinin teşvik edilmesidir.
Koenzimler:
Hücresel fizyolojide, birçok enzimatik reaksiyon, koenzimlerin varlığında tamamlanır. Bunlar, enzimler gibi çalışan bileşiklerdir, yani biyolojik reaksiyonları hızlandırırlar, ancak gerçek enzimler gibi proteinler değillerdir.
Tanım:
Bir koenzim, belirli bir kofaktör türü, yani protein olmayan bir organik bileşik veya belirli bir enzimle birlikte işleyen bir taşıyıcı molekül olarak tanımlanabilir.
Kofaktör apoenzime sıkıca bağlıysa prostetik grup olarak adlandırılır; ve eğer apoenzime az çok kalıcı olarak bağlı kalmak yerine, organik kofaktör kendisini yalnızca reaksiyon sırasında enzim proteinine bağlarsa, buna koenzim denir.
Hücresel işlemlerde bazen hidrojen atomları veya elektronlar bir bileşikten uzaklaştırılır ve diğerine aktarılır. Tüm bu durumlarda, spesifik bir enzim uzaklaştırmayı katalize eder, ancak transferi gerçekleştirmek için özel bir koenzim de mevcut olmalıdır. Koenzim geçici olarak uzaklaştırılan atom grubuna katılır veya kabul eder ve daha sonra bunları başka bir alıcı bileşiğe devredebilir.
Koenzimlerin Kimyasal Yapısı:
Koenzimlerin çoğu, nükleotidlerin kimyasal türevleridir. Daha spesifik olarak, çoğu koenzimde nükleotidlerin azot bazı kısmı başka bir kimyasal birim ile ikame edilir. Bu ünitenin kendisi genellikle belirli bir vitamin türevidir. Aşağıdaki koenzimler, hücresel fizyolojide önemlidir.
(i) Flavin türevleri veya Flavin nükleotitleri (FMN ve FAD)
(ii) Piridin türevleri veya Piridin nükleotitleri (NAD ve NADP).
(iii) Koenzim A
(iv) Koenzim Q
(iv) Sitokromlar
(vi) Tiamin pirofosfat
Burada sadece iki koenzim açıklanmaktadır.
1. Flavin Nükleotidleri veya Flavoproteinleri:
Büyük bir solunum yolu enzimi grubu, kofaktörü olarak iki riboflavin türevinden birini (B2 vitamini) kullanır. Bunlar flavin mononükleotidi (FMN) ve flavin adenin nükleotididir (FAD).
Yapısı:
Riboflavin, bir riboz proteini ve bir flavin bölümünden oluşan bir bileşiktir; ikincisi, kompleks bir üçlü halka yapısıdır. Hücrelerde, bir fosfat grubu, flavin mononükleotidi (FMN) veya riboflavin monofosfat olarak bilinen bir nükleotit benzeri kompleks ile sonuçlanan riboflavin ile bağlanır. FMN AMP'ye katılırsa, flavin adenin dinükleotidi (FAD) olarak bilinen bir dinükleotit oluşur.


Fonksiyonlar:
FMN veya FAD'nin bir apoenzim ile kombinasyonuna flavoprotein (FP) adı verilir. Flavoproteinler, hidrit iyonunun (H - ) ve hidrat iyonunun (H + ) bir metabolitten uzaklaştırılmasını katalize etti. Bu koenzimlerde, geçici hidrojen bağlanması için spesifik bir yer sağlayan molekülün flavin kısmıdır.
FMN + MH 2 ——–> FADH 2 + M
FMN + MH 2 ——–> FMNH 2 + M
Bu reaksiyonda MH, bir substratı temsil eder, FADH, indirgenmiş FAD şeklidir ve FMNH2, indirgenmiş FMN şeklidir. Bu reaksiyon için önemli bir hidrojen kaynağı, indirgenmiş piridin nükleotididir.
H + + NADH + FAD ——–> NAD + + FADH 2
Tüm durumlarda, indirgenmiş flavoproteinler elektronlarından sitokromlara geçer.
2. Koenzim Q:
Bu enzim ubiquinone olarak bilinen bir kinondur ve esas olarak mitokondride bulunur, fakat aynı zamanda mikrozom ve hücre çekirdeğinde vs. bulunur.
Yapısı:
Koenzim Q veya ubiquinone, uzunluğu mitokondri kaynağına göre değişen bir yan zincire sahip bir kinondan oluşur. Çoğu hayvan dokusunda, kinon, yan zincirinde 10 izoprenosid ünitesine sahiptir ve koenzim Q10 olarak adlandırılır.
İşlev:
Koenzim Q, mitokondride elektron taşıma zincirinin gerekli bir bileşenidir. Flavin koenzimleri (FAD ve FMN) ve sitokromlar arasında ilave bir hidrojen taşıyıcı görevi görür.
Q + FADH 2 ——-> QH 2 + FAD
Azaltılmış (QH2), elektronlarını mitokondride sitokrom b'ye aktarır.